GIF wycofuje z obrotu 10 serii leku Diprophos
- Publikacja:
- 2023-02-01 18:27
- Aktualizacja:
- 2025-06-03 14:20
31 stycznia 2023 r. Główny Inspektorat Farmaceutyczny wydał komunikat o wycofaniu z obrotu na terenie całego kraju aż 10 serii leku Diprophos – glikokortykosteroidu stosowanego w terapii przewlekłych i ostrych stanów, które reagują na leczenie kortykosteroidami. Ponadto, wydano również decyzję zakazującą wprowadzania do obrotu kolejnych 3 serii tego preparatu. Co było powodem wycofania i których partii leku dotyczy decyzja GIF?

Lek Diprophos – wskazania do stosowania
Lek Diprophos ma postać zawiesiny do wstrzykiwań, w której jako substancję czynną zastosowano betametazon – glikokortykosteroidy do stosowania w leczeniu przewlekłych oraz ostrych stanów, które reagują na leczenie kortykosteroidami. Lek ten stosuje się w rozmaitych schorzeniach:
- chorobach układu mięśniowo-szkieletowego i tkanek miękkich (m.in. reumatoidalne zapalenie stawów, zesztywniające zapalenie stawów kręgosłupa, zapalenie korzeni nerwowych, lumbago);
- schorzeniach alergicznych, takich jak przewlekła astma oskrzelowa, katar sienny, ukąszenia owadów, obrzęk naczynioruchowy;
- chorobach skóry (np. atopowe zapalenie skóry, pokrzywka, liszaj płaski, łysienie plackowate, toczeń rumieniowaty, łuszczyca, pęcherzyca;
- kolagenozach (m.in. toczeń rumieniowaty, twardzina skóry).
Preparat ten ma zastosowanie w leczenie wielu innych schorzeń, w tym we wrzodziejącym zapaleniu jelita grubego, chorobie Leśniowskiego-Crohna czy zapalenia nerek i zespołu nerczycowego.
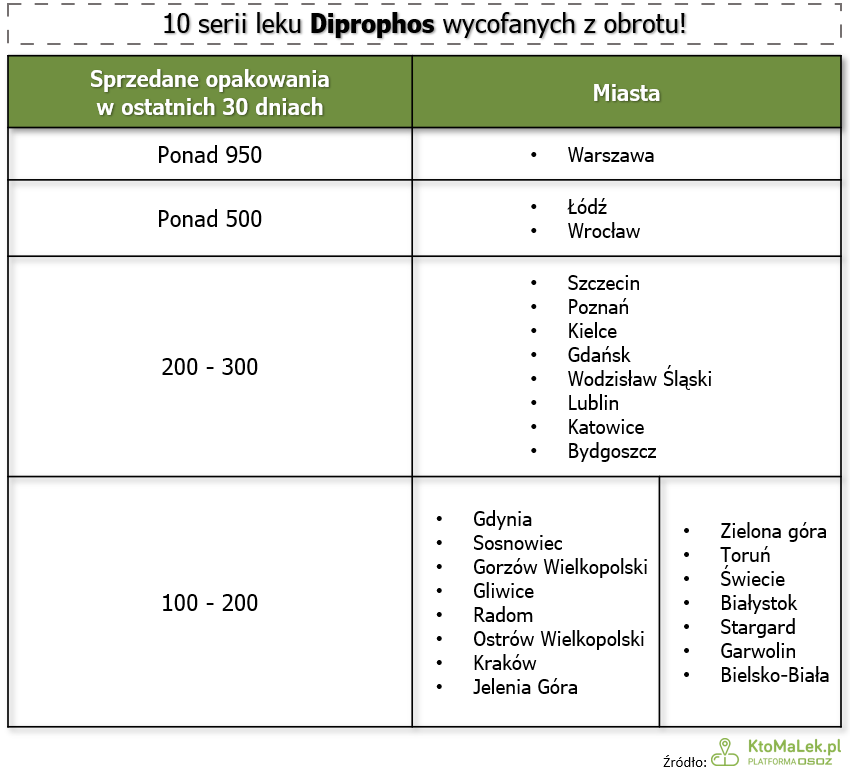
W których miastach sprzedano najwięcej opakowań wadliwych serii leku Diprophos?
Według danych KtoMaLek.pl ciągu ostatnich 30 dni w całym kraju sprzedano blisko 16 000 opakowań wadliwych serii leku Diprophos. Najwięcej, bo ponad 900 opakowań, sprzedano na terenie Warszawy. Również w innych miastach wojewódzkich pacjenci wykupili znaczne ilości leku – ponad 500 opakowań w Łodzi i Wrocławiu oraz przeszło 200 opakowań m.in. w Szczecinie, Poznaniu, Kiecach, Gdańsku czy Wodzisławiu Śląskim.
Dlaczego wycofano z obrotu 10 serii leku Diprophos?
Główny Inspektorat Farmaceutyczny otrzymał Rapid Alert klasy II, przesłany przez organ belgijski (Federal Agency for Medicinal and Health Products dalej FAMHP), który dotyczył wycofania konkretnych serii leku Duprophos. W komunikacie wskazano, że istnieje możliwość wystąpienia brązowych cząstek o metalicznym wyglądzie, które zostały zidentyfikowane jako cząstki stali nierdzewnej. Jak możemy przeczytać w komunikacie:
FAMHP na podstawie przeprowadzonej oceny medycznej nie stwierdził zagrożenia występowania ogólnoustrojowych skutków ubocznych w związku ze stwierdzoną niezgodnością natomiast ocenił, iż nie można wykazać bezpieczeństwa stosowania ww. produktu, w odniesieniu do potencjalnych reakcji miejscowych, zwłaszcza nowych, zaostrzonych lub przedłużających się stanów zapalnych i reakcji nadwrażliwości. FAMHP zarekomendowało wycofanie serii objętych zawiadomieniem.
Ponadto z GIF wpłynęło także zawiadomienie przesłane przez podmiot odpowiedzialny, dotyczące potencjalnego defektu leku Diprophos. Firma również zarekomendowała profilaktyczne wycofanie produktu na poziomie hurtowym oraz poinformowała, że seria W036601 w całości została wstrzymana w obrocie (nie zostanie wprowadzona na rynek), z kolei serie W030205 i W033583 zostały wczęściowo wprowadzone do obrotu, a częściowo wstrzymane u wytwórcy.
W trakcie czynności wyjaśniających GIF uzyskał również stanowisko Ministra Zdrowia, poparte opinią Konsulstanta Krajowego w dziedzinie endokrynologii, który wskazał, że w Polsce nie ma odpowiedników leki Diprophos, jednakże są dostępne inne produktu o zbliżonym działaniu. Jednocześnie Konsultant Krajowy zwrócił uwagę na fakt, że nieznane jest faktyczne zagrożenie opisanej wady, dlatego rekomenduje wycofanie pozostałych w obrocie opakowań leku. Do opinii tej przychylił się Minister Zdrowia.
Mając powyższe na uwadze, Główny Inspektor Farmaceutyczny podjął decyzję zakazie wprowadzania do obrotu oraz o wycofaniu z obrotu na terenie całego kraju ww. serii przedmiotowego produktu leczniczego.
Zgodnie z decyzją nr 5/2023 wycofano z obrotu na terenie całego kraju produkt leczniczy Diprophos (Betamethasoni dipropionas + Betamethasoni natrii phosphas) (6,43 mg + 2,63 mg)/ml, zawiesina do wstrzykiwań o numerach serii:
- numer serii: U020696, data ważności: 28.02.2023
- numer serii: U025861, data ważności: 28.02.2023
- numer serii: U031798, data ważności: 30.04.2023
- numer serii: U034874, data ważności: 31.08.2023
- numer serii: U034876, data ważności: 31.07.2023
- numer serii: U038446, data ważności: 30.09.2023
- numer serii: W001593, data ważności: 30.09.2023
- numer serii: W005750, data ważności: 31.10.2023
- numer serii: W030205, data ważności: 31.07.2024
- numer serii: W033583, data ważności: 31.08.2024
Na mocy decyzji nr 1/2023 zakazano wprowadzania do obrotu na terenie całego kraju produktu leczniczego Diprophos (Betamethasoni dipropionas + Betamethasoni natrii phosphas) (6,43 mg + 2,63 mg)/ml, zawiesina do wstrzykiwań o numerach serii:
- numer serii: W030205, data ważności: 31.07.2024
- numer serii: W033583, data ważności: 31.08.2024
- numer serii: W036601, data ważności: 30.09.2024
Podmiotem odpowiedzialnym jest Organon Polska Sp. z o.o. ul. Marszałkowska 126/134, 00-008 Warszawa.
Źródła:
1. https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4331
2. https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4332
3. https://rejestrymedyczne.ezdrowie.gov.pl/api/rpl/medicinal-products/1945/characteristic
Autor
Redakcja ktomalek.pl - Zespół redakcyjny KtoMaLek.pl tworzą doświadczeni farmaceuci, którzy specjalizują się w różnych obszarach tematyki zdrowotnej. Doświadczenie zdobyte w zawodzie oraz wiedza uzyskana podczas studiów farmaceutycznych, pozwalają na tworzenie merytorycznych treści zgodnych z EBM (and. Evidence-based Medicine), opartych na rzetelnych źródłach — aktualnych badaniach naukowych, branżowych podręcznikach i książkach. Za praktyką podążają również pasja i niesłabnąca chęć do poszerzania wiedzy oraz dzielenia się nią z pacjentami. Dzięki temu użytkownicy otrzymują dostęp do ciekawych i angażujących materiałów edukacyjnych.