GIF wycofuje 33 serie leku Accupro
- Publikacja:
- 2022-04-26 14:08
- Aktualizacja:
- 2023-12-06 11:23
25 kwietnia 2022 r. Główny Inspektorat Farmaceutyczny wydał decyzje, na mocy której wycofano z obrotu aż 33 serie leku na nadciśnienie Accupro. Powodem wycofania było wykrycie zanieczyszczenia w konkretnych partiach preparatu. Sprawdźcie, czy nie macie w swojej apteczce wadliwej serii leku!

Lek Accupro – kiedy się stosuje?
Substancją czynną leku Accupro jest chinapryl - lek na nadciśnienie zaliczający się do inhibitorów konwertazy angiotensyny, które działają na jeden z enzymów wchodzących w skład układu renina-angiotensyna-aldosteron. Lek Accupro dostępny jest w czterech dawkach – 5, 10, 20 i 40 mg.
Lek Accupro wskazany jest w leczeniu samoistnego nadciśnienia tętniczego (w monoterapii lub w skojarzeniu z lekami moczopędnymi i beta-adrenolitykami) oraz w terapii zastoinowej niewydolności serca (leczenie skojarzone z diuretykami i/lub glikozydami naparstnicy).
Lek wydawany jest wyłącznie na receptę.
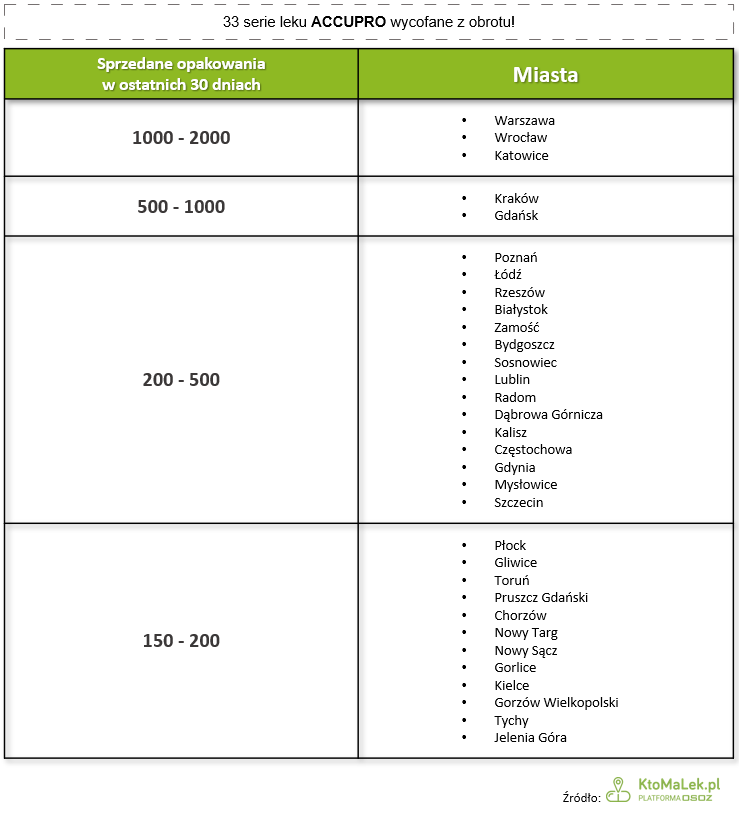
W których miastach sprzedano najwięcej opakowań wadliwych serii leków?
W ciągu ostatnich 30 dni sprzedano ponad 30 000 opakowań wadliwych serii leku Accupro. Najwięcej z nich sprzedano w dużych ośrodkach miejskich (m.in. Warszawa, Kraków, Wrocław, Katowice), a także mniejszych miejscowościach.
Dlaczego wycofano 33 serie leku Accupro?
Wycofanie 33 serii leku Accupro nastąpiło na wniosek podmiotu odpowiedzialnego. W piśmie przesłanym do GIF podmiot odpowiedzialny zwrócił się z prośbą o wycofanie konkretnych serii produktów w związku z wykryciem w nich zanieczyszczenia (N-Nitroso-quinapril) powyżej dopuszczalnego dziennego limitu spożycia.
Z danych udostępnionych przez serwis KtoMaLek.pl wynika, że każdego miesiąca w Polsce sprzedaje się około 30 000 – 33 000 opakowań leku Accupro w różnych dawkach. Tylko w marcu 2022 roku sprzedano przeszło 33 tysiące opakowań tego preparatu. Osoby, które stosują ten lek, powinny sprawdzić numer serii i datę ważności na opakowaniu. Jeżeli jest to wadliwa seria, należy skontaktować się z lekarzem prowadzącym, który podejmie decyzję dotyczącą dalszej farmakoterapii.
Zgodnie z decyzja nr 11/2022 wydaną 25 kwietnia 2022 r. wycofano z obrotu na terenie całego kraju produkty lecznicze:
ACCUPRO 5 (Quinaprilum) 5 mg, tabletki powlekane, opakowanie 30 tabletek
- numer serii: FR1997, data ważności: 30.11.2024
- numer serii: FF2033, data ważności: 31.10.2022
- numer serii: ET1536, data ważności: 31.10.2022
- numer serii: DR4162, data ważności: 31.10.2022
- numer serii: DC1456, data ważności: 30.09.2022
ACCUPRO 10 (Quinaprilum) 10 mg, tabletki powlekane, opakowanie 30 tabletek
- numer serii: FN2870, data ważności: 30.06.2023
- numer serii: FJ0419, data ważności: 30.06.2023
- numer serii: FE6831, data ważności: 30.04.2023
- numer serii: EY7391, data ważności: 30.04.2023
- numer serii: EM1556, data ważności: 30.04.2023
- numer serii: EJ7128, data ważności: 30.04.2023
- numer serii: EA0782, data ważności: 30.04.2023
- numer serii: EN8321, data ważności: 30.04.2023
- numer serii: EA0784, data ważności: 30.11.2022
- numer serii: DM5062, data ważności: 30.11.2022
ACCUPRO 20 (Quinaprilum) 20 mg, tabletki powlekane, opakowanie 30 tabletek
- numer serii: FM6645, data ważności: 30.06.2023
- numer serii: FM3990, data ważności: 30.06.2023
- numer serii: FL1132, data ważności: 30.06.2023
- numer serii: FJ1090, data ważności: 30.06.2023
- numer serii: FG9082, data ważności: 30.06.2023
- numer serii: FD9328, data ważności: 30.06.2023
- numer serii: EY3975, data ważności: 30.06.2023
- numer serii: ET1538, data ważności: 30.04.2023
- numer serii: EP1566, data ważności: 30.04.2023
- numer serii: EJ7141, data ważności: 30.04.2023
- numer serii: EF2674, data ważności: 30.04.2023
- numer serii: EA7792, data ważności: 30.04.2023
- numer serii: DT1742, data ważności: 30.04.2023
- numer serii: DM5061, data ważności: 30.11.2022
- numer serii: DA9320, data ważności: 30.09.2022
ACCUPRO 40 (Quinaprilum) 40 mg, tabletki powlekane, opakowanie 28 tabletek
- numer serii: FN6679, data ważności: 30.04.2024
- numer serii: FM6646, data ważności: 30.04.2024
- numer serii: FG9088, data ważności: 30.04.2024
Podmiotem odpowiedzialnym jest Pfizer Europe MA EEIG z siedzibą w Belgii.
Źródło:
https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4300
https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4301
https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4302
https://rdg.ezdrowie.gov.pl/Decision/Decision?id=4303
Autor
Redakcja ktomalek.pl - Zespół redakcyjny KtoMaLek.pl tworzą doświadczeni farmaceuci, którzy specjalizują się w różnych obszarach tematyki zdrowotnej. Doświadczenie zdobyte w zawodzie oraz wiedza uzyskana podczas studiów farmaceutycznych, pozwalają na tworzenie merytorycznych treści zgodnych z EBM (and. Evidence-based Medicine), opartych na rzetelnych źródłach — aktualnych badaniach naukowych, branżowych podręcznikach i książkach. Za praktyką podążają również pasja i niesłabnąca chęć do poszerzania wiedzy oraz dzielenia się nią z pacjentami. Dzięki temu użytkownicy otrzymują dostęp do ciekawych i angażujących materiałów edukacyjnych.