Sodu ryzedronian był stosowany w badaniach klinicznych III fazy u ponad 15 000 pacjentów. Większość działań niepożądanych obserwowanych w badaniach klinicznych była łagodna lub umiarkowana i zwykle nie wymagała przerwania leczenia.
Działania niepożądane zgłaszane w badaniach klinicznych III fazy u kobiet z osteoporozą po menopauzie leczonych do 36 miesięcy ryzedronianem w dawce 5 mg/dobę (n=5020) lub placebo (n=5048) i uznane za możliwe lub prawdopodobnie związane ze stosowaniem ryzderonianu są wymienione poniżej zgodnie z następującą konwencją (częstość zdarzeń w porównaniu z placebo podano w nawiasach): bardzo często (≥ 1/10); często (≥ 1/100; < 1/10); niezbyt często (≥ 1/1000; < 1/100); rzadko (≥ 1/10 000; < 1/1000); bardzo rzadko (< 1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu nerwowego:
Często: ból głowy (1,8% w porównaniu z 1,4%).
Zaburzenia oka:
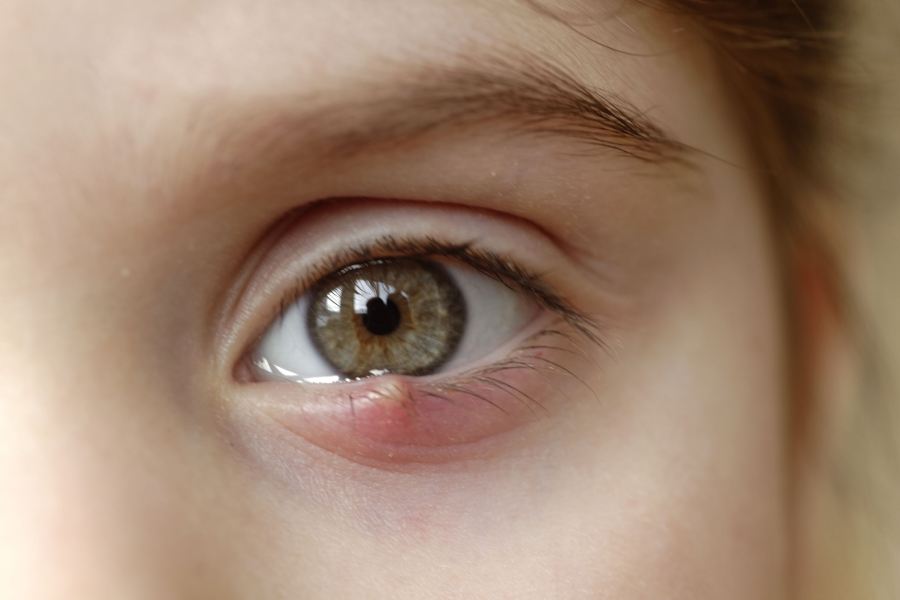
Niezbyt często: zapalenie tęczówki*.
Zaburzenia żołądka i jelit:
Często: zaparcie (5,0% w porównaniu z 4,8%), niestrawność (4,5% w porównaniu z 4,1%), nudności (4,3% w porównaniu z 4,0%), ból brzucha (3,5% w porównaniu z 3,3%), biegunka (3,0% w porównaniu z 2,7%).
Niezbyt często: zapalenie błony śluzowej żołądka (0,9% w porównaniu z 0,7%), zapalenie błony śluzowej przełyku (0,9% w porównaniu z 0,9%), utrudnienie połykania (0,4% w porównaniu z 0,2%), zapalenie błony śluzowej dwunastnicy (0,2% w porównaniu z 0,1%), owrzodzenie przełyku (0,2% w porównaniu z 0,2%).
Rzadko: zapalenie języka (< 0,1% w porównaniu z 0,1%), zwężenie przełyku (< 0,1% w porównaniu z 0,0%).
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej:
Często: bóle mięśniowo-kostne (2,1% w porównaniu z 1,9%).
Badania diagnostyczne:
Rzadko: zmiany wskaźników badań prób czynnościowych wątroby*.
* Przypadki nie związane z badaniami III fazy u pacjentów z osteoporozą, częstość w oparciu o działania niepożądane i (lub) wyniki badań laboratoryjnych z wcześniejszych faz badań klinicznych.
Wskaźniki laboratoryjne: U niektórych pacjentów na początku leczenia obserwowano przemijające, bezobjawowe i łagodne zmniejszenie stężenia wapnia i fosforanów w surowicy.
Następujące dodatkowe działania niepożądane opisano po wprowadzeniu produktu leczniczego do obrotu:
Zaburzenia oka:
Częstość nieznana: zapalenie tęczówki, zapalenie błony naczyniowej oka
Zaburzenia mięśniowo – szkieletowe i tkanki łącznej:
Rzadko: nietypowe złamania podkrętarzowe i trzonu kości udowej (działanie niepożądane leków należących do klasy bisfosfonianów) Częstość nieznana: martwica kości szczęki
Zaburzenia skóry i tkanki podskórnej:
Częstość nieznana: nadwrażliwość i reakcje skórne w tym obrzęk naczynioruchowy, uogólniona wysypka, pokrzywka i pęcherze skórne, czasami o ciężkim przebiegu, w tym pojedyncze przypadki zespołu Stevens-Johnsona, toksyczne martwicze oddzielanie się naskórka i leukocytoklastyczne zapalenie naczyń, łysienie.
Zaburzenia układu immunologicznego:
Częstość nieznana: reakcja anafilaktyczna
Zaburzenia wątroby i dróg żółciowych:
Częstość nieznana: Ciężkie zaburzenia czynności wątroby. W większości zgłoszonych przypadków pacjenci byli również leczeni innymi lekami o znanym wpływie na zaburzenia wątroby.