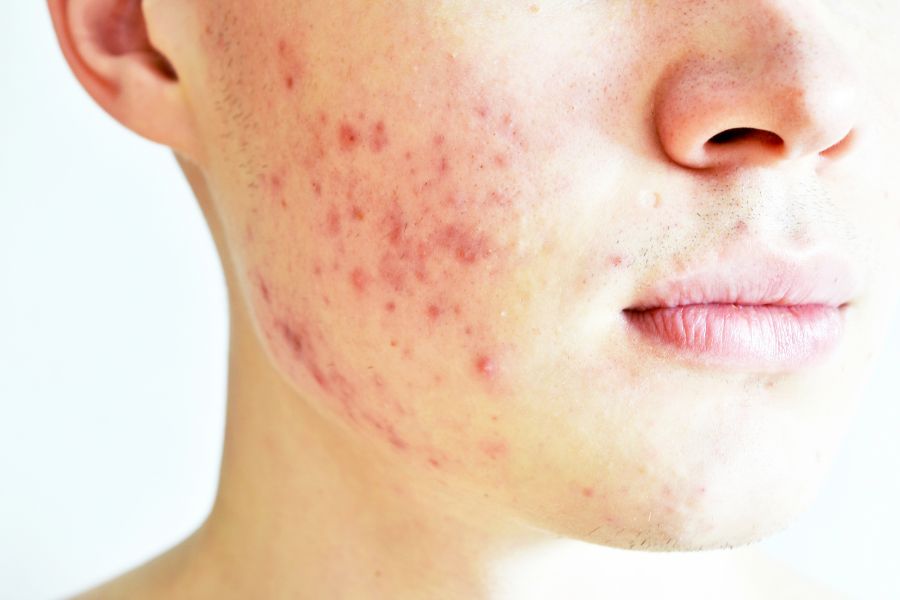
W trakcie głównych, kontrolowanych placebo badań klinicznych nad stosowaniem produktu EFRACEA w leczeniu trądziku różowatego, 269 pacjentów otrzymywało przez 16 tygodni raz na dobę 40 mg EFRACEA, a 268 pacjentów - placebo. Działania niepożądane dotyczące przewodu pokarmowego ogółem wystąpiły u większej liczby pacjentów przyjmujących EFRACEA (13,4%), niż placebo (8,6%). Najczęściej zgłaszanymi działaniami niepożądanymi u pacjentów przyjmujących EFRACEA, tj. takimi, które wystąpiły u ≥ 3% pacjentów przyjmujących EFRACEA, a zarazem, co najmniej o 1% więcej, niż u pacjentów przyjmujących placebo, było zapalenie nosa i gardła, biegunka i nadciśnienie.
Poniższa tabela przedstawia działania niepożądane po podaniu produktu EFRACEA w trakcie głównych badań klinicznych z grupą kontrolną otrzymującą placebo, tj. działania niepożądane, które wystąpiły o ≥ 1% częściej u pacjentów przyjmujących EFRACEA, niż u pacjentów przyjmujących placebo. Działania niepożądane zgłaszane dla całej grupy antybiotyków pochodnych tetracykliny wymieniono w poniższej tabeli. Posłużono się następującymi kategoriami częstości:
często: ≥ 1/100 do < 1/10
niezbyt często: ≥ 1/1 000 do < 1/100
rzadko: ≥ 1/10 000 do < 1/1 000 bardzo rzadko: < 1/10 000
Działania niepożądane a po zastosowaniu produktu EFRACEA w leczeniu trądziku różowatego podczas głównych, randomizowanych badań klinicznych, z grupą kontrolną otrzymującą placebo
| Klasyfikacja układów i narządów MedDRA | Często: częstość ≥ 1/100, < 1/10 |
| Zakażenia i zarażenia pasożytnicze | zapalenie nosa i gardła zapalenie zatok zakażenie grzybicze |
| Zaburzenia psychiczne | lęk |
| Zaburzenia układu nerwowego | ból głowy zatokowy |
| Zaburzenia naczyniowe | nadciśnienie |
| Zaburzenia żołądka i jelit | biegunka ból w nadbrzuszu suchość w jamie ustnej |
| Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | ból pleców |
| Zaburzenia ogólne i stany w miejscu podania | ból |
| Badania diagnostyczne | zwiększona aktywność AspAT podwyższone ciśnienie krwi zwiększona aktywność LDH we krwi podwyższone stężenie glukozy we krwi |
a określone, jako zdarzenia niepożądane, których częstość występowania w grupie otrzymującej EFRACEA była wyższa niż w grupie placebo (o co najmniej 1%)
Łagodne nadciśnienie wewnątrzczaszkowe oraz ból głowy (częstość nieznana: nie może być określona na podstawie dostępnych danych) były zgłaszane podczas obserwacji po wprowadzeniu leku do obrotu.
U pacjentów przyjmujących tetracykliny zaobserwowano przedstawione poniżej działania niepożądane.
Zakażenia i zarażenia pasożytnicze
Bardzo rzadko: zakażenie drożdżakowe odbytowo-płciowe
Zaburzenia krwi i układu chłonnego
Rzadko: małopłytkowość, neutropenia, eozynofilia
Bardzo rzadko: niedokrwistość hemolityczna
Zaburzenia układu immunologicznego
Rzadko: reakcje nadwrażliwości, w tym reakcja anafilaktyczna
Notowano również plamicę rzekomoanafilaktyczną
Zaburzenia endokrynologiczne
Bardzo rzadko: podczas długotrwałego stosowania tetracyklin zgłaszano brązowo-czarne mikroskopijne zabarwienia miąższu tarczycy. Czynność tarczycy pozostawała prawidłowa.
Zaburzenia układu nerwowego
Rzadko: łagodne nadciśnienie śródczaszkowe
Bardzo rzadko: wypukłe ciemiączko u niemowląt
Jeśli wystąpią objawy zwiększonego ciśnienia śródczaszkowego, leczenie należy przerwać. Objawy te znikają szybko po odstawieniu leku.
Zaburzenia serca
Rzadko: zapalenie osierdzia
Zaburzenia żołądka i jelit
Rzadko: nudności, wymioty, biegunka, jadłowstręt
Bardzo rzadko: zapalenie języka, dysfagia, zapalenie jelita cienkiego i okrężnicy. Zapalenie przełyku i
owrzodzenie przełyku najczęściej zgłaszano u pacjentów przyjmujących doksycyklinę w postaci hyklanu, w kapsułkach. Większość z tych pacjentów przyjmowała lek tuż przed położeniem się do łóżka.
Zaburzenia wątroby
Rzadko: działanie toksyczne na wątrobę
Zaburzenia skóry i tkanki podskórnej
Rzadko: wysypki grudkowo-plamkowe i rumieniowate, nadwrażliwość skóry na światło, pokrzywka
Bardzo rzadko: zapalenie skóry złuszczające, obrzęk naczynioruchowy
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Bardzo rzadko: zaostrzenie toczenia rumieniowatego układowego
Zaburzenia nerek i dróg moczowych
Rzadko: podwyższone stężenie mocznika we krwi.
Wystąpienie działań niepożądanych typowych dla leków z grupy tetracyklin są mniej prawdopodobne podczas stosowania produktu leczniczego Efracea, z powodu zmniejszonego dawkowania i związanych z tym względnie niskich stężeń w osoczu. Niemniej jednak klinicysta powinien zawsze brać pod uwagę możliwość wystąpienia działań niepożądanych i powinien odpowiednio kontrolować pacjentów.